在动物实验中给予动物受试物后,除了观察其外观和表征,还可能需要采集动物的血液等体液进行检测,以进一步观察动物的生理、生化指标的变化,因此采血是动物实验中最常用的操作技术之一。
1、全血、血浆、血清的区别
全血包括血细胞和血浆的所有成分。采集全血时,收集管中必须含有抗凝剂。常用的抗凝剂有:肝素、柠檬酸钠和乙二胺乙酸酸(EDTA)。根据不同研究需要进行选择。
血浆是全血经抗凝处理后,通过离心沉淀,获得的不含细胞成分的液体。含有纤维蛋白原、凝血因子等。血清是全血未经过抗凝处理,血凝块聚缩释出的液体。其中没有纤维蛋白原和凝血因子。分离血浆和血清的一般方法是:2200-2500rpm 离心至少15分钟。

注意:溶血现象
正常的血清或者血浆样本为黄色清液,而若为偏红,即为有红细胞破裂而产生溶血现象。
避免溶血应注意以下的事项:
1.采血时要避免小鼠毛发、油脂沾染血液导致溶血,所用的容器、注射器必须清洁干燥,不能有水或者有机溶剂。
2.抽血时速度不要太快,速度太快会有气泡产生。如果使用止血带时,止血带不要扎得太久。
3. 抽出的血放入试管时,要先拔掉针头再放血,同时速度不要太快。
4. 收集分离血清的全血时应尽量使血液直接进入小管底部,避免管壁或管盖上的血液在离心过程中导致溶血。
2、如何完成一次采血?
采血技能在临床辅助诊断和监测病情进展等方面是一项非常关键的技术。采血不能简单的看成以静脉穿刺和血液吸入注射器为开始和结束;血样必须安全放置并保证完整,全程精心护理。
(1)仔细计划,选择合适器材
采血需要准备和计划,包括采血量、采血部位、采血方法和采血顺序,确保采血成功。对于脆弱和细小的静脉,需要一个小规格的针头;如果血管大小允许,大规格的针头能为快速、大容量的采血提供最佳血流。采血体积也决定了注射器尺寸。
如何确定采血体积?
实验动物采血时应注意不宜一次采血量过多或采血过于频繁,否则因采血可影响动物健康,造成贫血,甚至死亡。血液采集的可接受量和频率取决于动物的循环血液量。常用实验动物循环血量见下表:
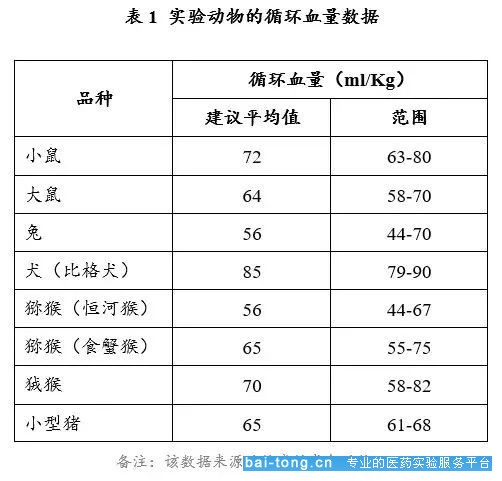
(来源:https://doi.org/10.1002/jat.727)
以25g的成年小鼠和250g的成年大鼠为例,通过上表计算可得一只体重为25g的小鼠循环血量约为0.025kg×72mL/kg=1.8mL;一只体重为250g的大鼠循环血量约为64mL/kg×0.25kg=16mL。
由于小鼠体重限制,一次取血后需要一定的恢复期以保证下次血液样本的质量,下表给出了不同采血量对应的恢复期:
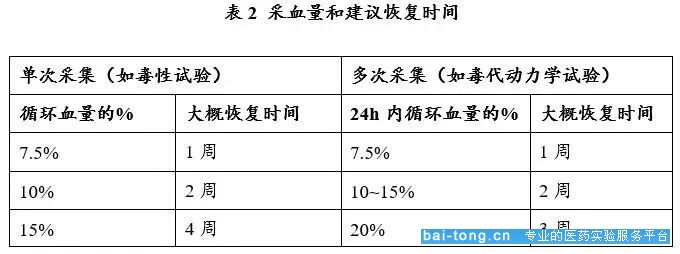
(来源:https://doi.org/10.1002/jat.727)
综合以上,我们一般采取以下原则进行采血:
(1.1)单次采血量不超过循环血量的10%。以25g小鼠为例,其单次采血最大值为0.025kg×72mL/kg×10%=0.18ml;
(1.2)如果实验需要多次采血,每周最大采血体积不超过循环血总体积的7.5%;每两周的最大采血体积不超过循环血总体积的15%。以250g大鼠为例计算其两周内最大采血量为0.25kg×64mL/kg×15%=2.4ml。
(1.3)仅当动物已安乐死或者在终点期时进行深度麻醉后才可以超过血液采集最大值。
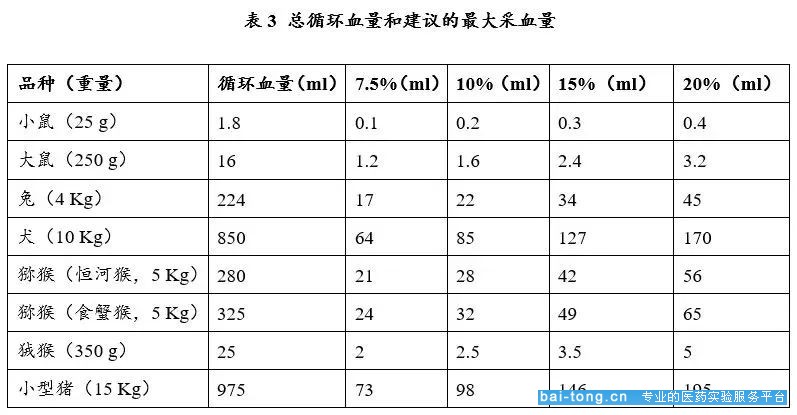
(来源:https://doi.org/10.1002/jat.727)
(2)选择合适采血部位
由于采血量的不同,因而采血的部位也不同。
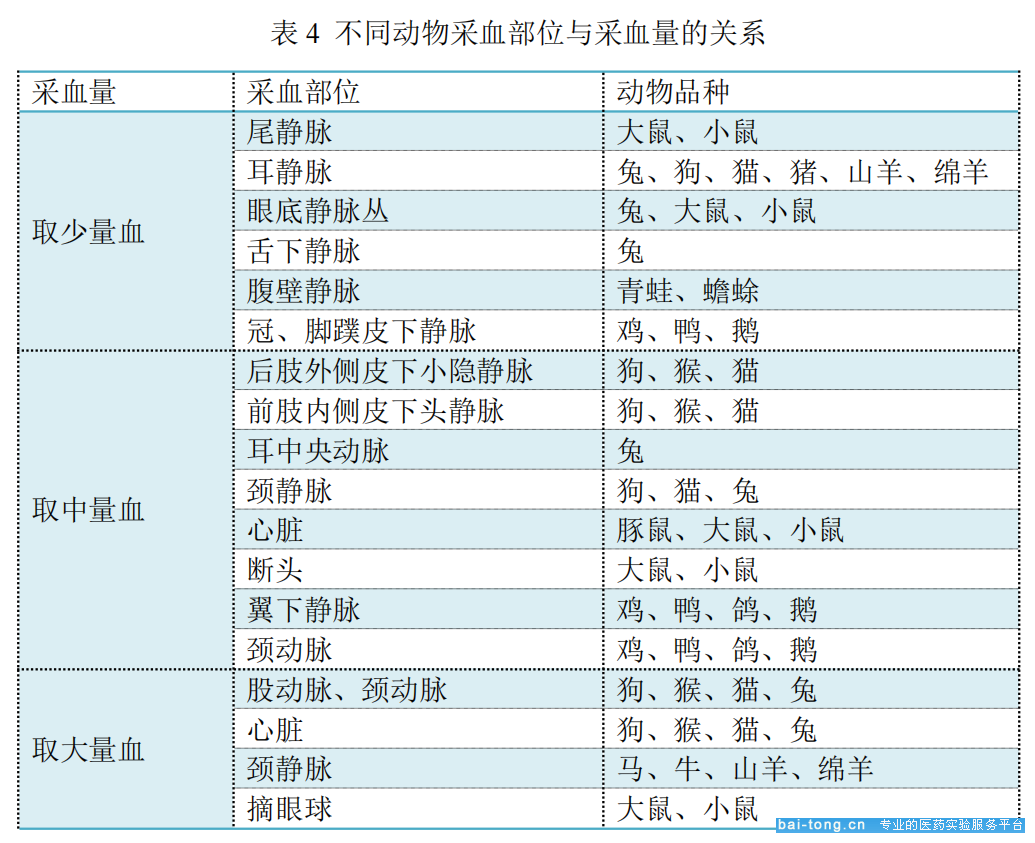
(来源:《实验动物科学》)
此外,上述多数的采血方法是需要麻醉的,麻醉方法也应根据实验需要进行选择。由于很多同学都是做小动物实验的,现在就以大小鼠为例,简单谈谈常见采血方法及特点:
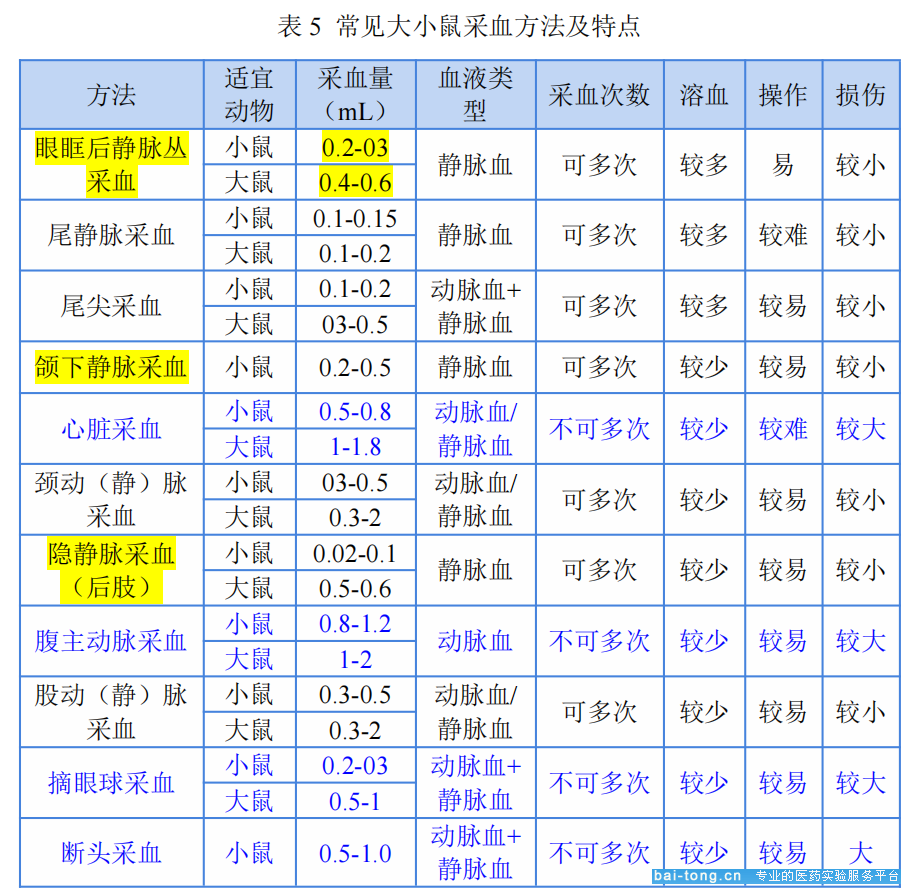
由于不同的采血方法对动物身体的损伤程度和操作方法不尽相同,尽量在满足实验要求的基础上选择简单易行且对动物伤害较小的采血方法。
(2.1)凡用血量较少的检验如红、白细胞计数,血红蛋白的测定,血液涂片以及酶活性微量分析法等,可刺破组织取毛细血管的血。
(2.2)当需血量较多时可作静脉采血。静脉采血时若需反复多次,应自远离心脏端开始,以免发生栓塞而影响整条静脉。
(2.3)如研究毒物对肺功能的影响、血液酸碱平衡、水盐代谢紊乱,需要比较动、静脉血氧分压、二氧化碳分压和血液pH以及K+、Na+、Cl-离子浓度,必须采取动脉血液。
如果没有特殊要求,大小鼠的终末采血都推荐安乐死或者深度麻醉后心脏采血,这种方式采血比较多,而且不容易污染。
对于小鼠,如果是非终点采血只有一两次,眼眶采血比较适合,采血量比较多,操作也很容易,但是需要麻醉(详细操作点击:大鼠眼眶采血标准操作规程);间断多次采血,推荐颌下静脉采血或隐静脉采血,这两种采血方法在操作前都不需要麻醉。而且对小鼠的伤害小,采血量与眼眶静脉丛采血法相当,采血后恢复快。
对于大鼠非终点采血,无论单次采血还是多次采血都比较推荐使用注射器进行颈静脉采血,随抓随采。如果不从尾静脉给药的话,尾静脉采血也是非常推荐的方式。
(3)了解具体的采血要求
不同的采样管需要特定检测样本,应事先计划合适抽血顺序,以防止由于试管添加剂污染而产生错误结果。采血时要注意:
①采血场所有充足的光线;室温夏季最好保持在25~28℃,冬季以15~20℃为宜;
②采血用具与采用部位一般需要进行消毒;
③采血用的注射器和试管必须保持清洁干燥;
④若需抗凝全血,在注射器或试管内需预先加入抗凝剂。
(4)结论
采血看似简单,但我们必须周密计划,注意细节,准确可靠,使动物经受最小的应激和伤害。
参考来源:
[1] Guidelines for the survival bleeding of mice and rats.
[2] A good practical guide to the administration of substances and removal of blood, including routes and volumes.(https://doi.org/10.1002/jat.727)
[3] 《实验动物科学》
3、采血方式大合集
以大小鼠为例:
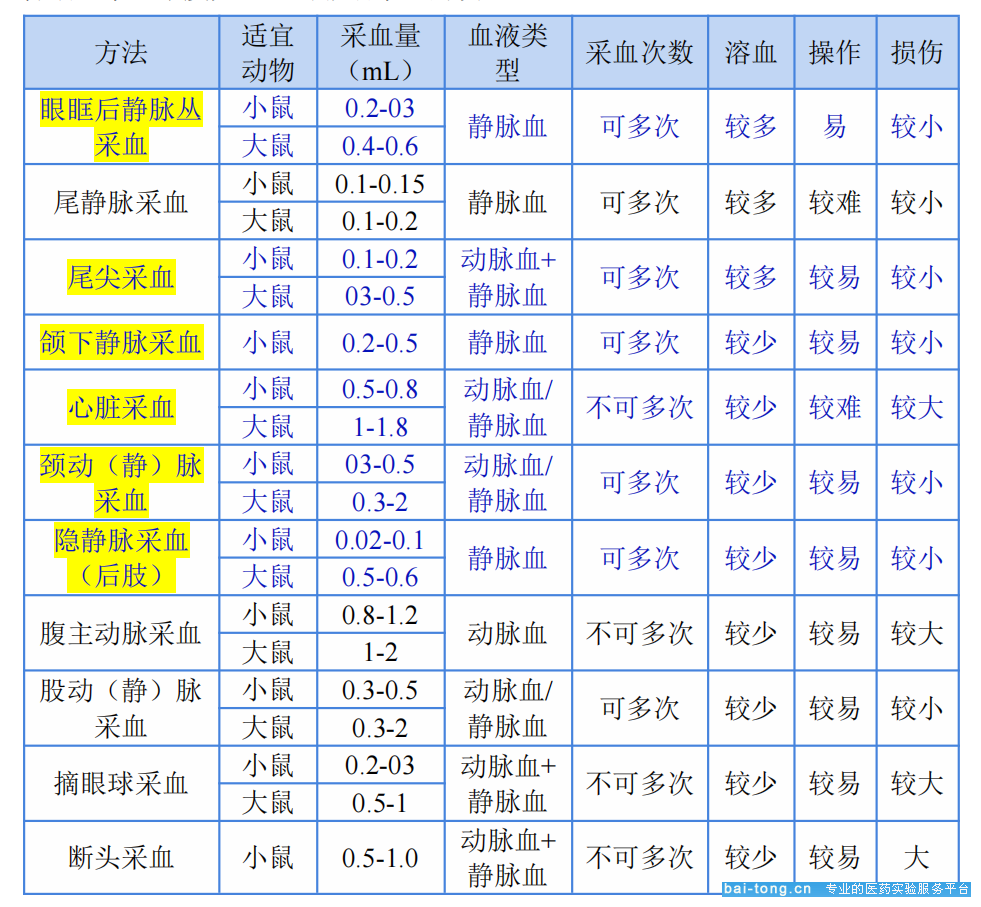
由于不同的采血方法对动物身体的损伤程度和操作方法不尽相同,尽量在满足实验要求的基础上选择简单易行且对动物伤害较小的采血方法。
今天我们重点具体介绍常见5种对实验鼠伤害小的采血方法(尾尖采血,眼眶静脉丛采血,颌下静脉采血,隐静脉采血和颈静脉采血)和1种终末采血(心脏采血)。
注:如果没有特殊要求,大小鼠的终末采血都推荐安乐死或者深度麻醉后心脏采血,这种方式采血比较多,而且不容易污染。
(3.1)尾尖采血(也就是剪尾采血)
当所需血量很少时采用本法。
采血方法:将小鼠麻醉后,固定动物并历出鼠尾,将鼠尾在45-50℃温水中浸泡数分钟,也可用二甲苯等化学药物涂擦,使局新血管扩张。擦干尾部,用酒精棉球消毒鼠尾,用无菌手术刀、刀片或锋利的剪刀,快速截断小鼠尾尖约1-2mm,可以从尾部向尾尖方向按摩,以增加血流(但是,这会降低血样的质量,增加溶血的风险),用毛细采血管收集血液,或直接滴入收集管中。采血结束后,用干棉球按压伤口或使用止血剂(如硝酸银,6%液体火棉胶)来止血。
应用:所需血量少的连续多次采血,如血糖或血常规的动态检测。
优点:操作较简单,动物不致死,可多次重复采血。
缺点:取血量太少,约0.1ml,采血速度慢,不适于样本大和需要较多血量的小鼠实验;不适用于老龄鼠;按摩鼠尾时可能会增加溶血的风险,易污染。
注意:流出的第一滴血可拭去。
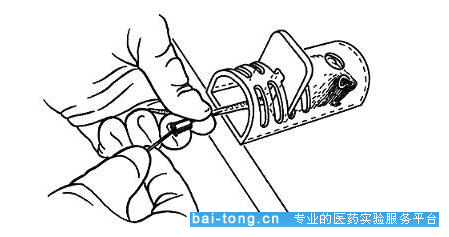
(3.2)眼眶静脉丛采血
采血方法:小鼠麻醉后,将小鼠侧卧位放置于动物台上,用左手拇指和食指压迫小鼠颈部两侧同时将皮肤向后拉(注意避免用力过度压迫气管),使眼球外突,提示眼眶后静脉丛充血。右手拿一毛细管(建议采用0.5*100mm规格的毛细管,在使用前折成小段,每段大约3-4cm),置于内侧眼角处,并且以与鼻翼平面成30-45度沿内眦插入内眼角,滑入眼球后方,轻轻向眼底方向刺入。不能刺地过深,一般小鼠2-3mm,大鼠4-5mm即可。当感到阻力时即停止推进,转180°使斜面对着眼眶后界,即有血液流出,若不行,将针退出约0.1-0.5mm,血液即通过毛细作用进入毛细管内。
采血结束后,立即松开手指对小鼠的压迫,使眼球复位,同时拔出毛细管。可用干棉球压住眼眶,确保止血。
应用:适用于需中等量血液、避免小鼠死亡的血液指标连续监测。
优点:眼眶后静脉丛采血法方法简单,便于掌握,采血成功率高,小鼠死亡率低,血流较快,采血量中等,小鼠约可采血0.2-0.3ml,大鼠约可采血0.4-0.6ml。
缺点:采血后需要至少需要10天的组织修复过程,否则会对采血量产生一定影响;不能采集到无菌的血样,血液中可能混有眼窝内的组织液和腺体分泌物,对于血样要求较高的研究,应谨慎使用;易损伤眼球,易感染,造成失明。
注意:多次建议左右两眼轮换取血;使用无菌的毛细管,避免感染。建议采用0.5*100mm规格的毛细管,在使用前折成小段,每段大约3-4cm。
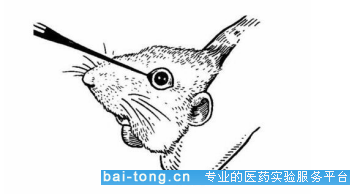
(3.3)颌下静脉采血
目前国际上一种最新的、最简单快捷的、最人道的采血方法!
采血方法:固定小鼠,可将小鼠侧卧,使小鼠头部尽量固定,对采血部位进行消毒,采血部位为小鼠头部下颌骨后方咬肌边缘颌下静脉丛血管处(大致在小鼠嘴角沿线与外眼角线相交处,会发现一个无毛的小点,有点像酒窝,基本位于嘴角远端稍低于下巴线)。将针垂直扎入采血部位,深度不超过针头的斜面(25g以内小鼠,可选用4号、5号注射针头,进针深度以1-2mm 为宜;25g以上成年小鼠可选用6号注射针头,进针深度以3-4mm 为宜)。拔出针头后血液流出,可使用毛细管收集或者直接将血液滴入采血管中,采血结束,立即用灭菌干棉球压迫止血。为方便采血,可使小鼠头部低于心脏高度。
应用:适用于需中等量血液、避免小鼠死亡的血液指标连续监测。
优点:对小鼠损伤小,采血所需时间很短;可反复采血,每次采血量约0.2-0.5ml;操作方便,无需麻醉;采血后动物恢复快;符合3R原则。
缺点:血液由下颌部被毛处流出,有可能粘连上毛发污染血液。
注意:需要熟练掌握找下颌静脉的位置;确保其头部和前肢不能摆动,防止血液洒落;注射针头的大小、进针的力度和深度要依照小鼠体重而定。
(3.4)隐静脉采血
小量、反复采血的常用方法。
采血方法:隐静脉采血无需麻醉,将小鼠放入合适的固定器中,但保持后肢可自由活动,后肢外侧区域剃毛后暴露采血点,为了使隐静脉更充盈,可在后腿膝盖以上使用止血带,在近尾侧的皮肤表面可以找到隐静脉。
酒精棉球擦拭采血部位消毒后,将灭菌注射针头垂直于皮肤迅速刺入后肢隐静脉(不要进针过深,以免刺穿肌肉或碰到骨头),松开止血带,血液流出,用毛细管收集血液于离心管中。采血结束后,用干棉球按压伤口或使用止血剂(如硝酸银,6%液体火棉胶)来止血,并将小鼠放回笼内。
应用:所需血量少的连续多次采血;药代动力学研究,以及生化指标和血液计数的检测。
优点:因其静脉位置表浅,穿刺准确性较高;无需麻醉,消除了麻醉剂对实验结果的影响。
缺点:取血量少,每次约0.02-0.1ml。
注意:寻找隐静脉时勿损伤血管。
(3.5)颈静脉采血(适用于大鼠)
采血方法:左手固定大鼠,使大鼠呈现腹部朝上的一个“十”字形,让大鼠颈部依靠在保定器上,颈部与前肢呈大于90°角,用头部固定器扭动颈部,使锁骨出现一个三角窝,去除锁骨附近被毛,酒精棉球擦拭消毒。右手持注射器,沿锁骨处进针(去除毛发后可清晰可见静脉处),刺穿皮肤后轻回拉注射器,使注射器产生负压。大约30度向上进针,当注射器内有血液出现时说明已经刺入采血位置,保持注射器,回拉注射器完成采血。采血完成后用干棉球稍按压止血即可。
应用:适用于人手少、动物数量多、实验时间紧以及药代动力学等需连续少量取血的研究中。
优点:相对于眼眶后静脉丛采血法对动物造成的疼痛感更小,更加符合动物福利,所以现在大有取代眼眶后静脉丛采血的趋势。本法适用于大鼠。
缺点:要求技术熟练,在一定时间内,如果采血量和采血次数增加,会使动物引起一定的应激性反应或采血部位的伤害。
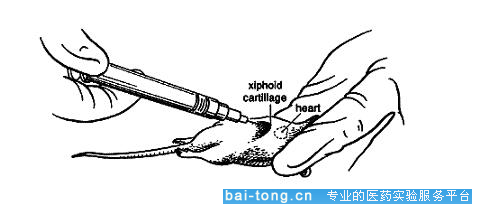
(3.6)心脏采血(非必需勿用)
采血方法:小鼠麻醉后,将鼠仰卧固定于动物台上,剪去胸前区被毛,皮肤消毒,右手用4-5号针头的注射器在左侧第3-4肋间心搏动最强处(一般位于两上肢连线下0.5cm中线稍偏左)进针刺入心内,缓慢回抽针筒,血液自动进入注射器中,再转移至采血管中。也可麻醉后剪开小鼠皮肤、肋骨,打开胸腔,暴露心脏,将注射器直接刺入心脏,抽取血液。
应用:适用于需血量大的实验终末期的动物采血;血常规、免疫、各种生化指标。
优点:无菌采血,抽血快,血液不易凝集,采血量大,小鼠采血量0.5-0.8ml,大鼠采血量1-1.5ml。
缺点:操作难度较大,但进针角度和深度不好把握,新手失败率高;心脏小,心率快,采血比较困难,可引起心包出血以及心包填塞致小鼠死亡;开胸直视采血容易剪破心脏大血管;需要麻醉。
注意:此法要求实验者掌握以下要点:要迅速而直接插入心脏,否则,心脏将从针尖处滑脱;如第一次没刺准,将针头抽出重刺,不要在心脏周围乱探,以免损伤心、肺;要缓慢而稳定的抽吸,否则,太多的真空反而使心脏塌陷。
(3.7)结论
伙伴们平时记得多加练习哦,早日实现一次采血成功。
4、实验动物各种体液采集方法
体腔液的收集
首先对采样部位进行剃毛与消毒。采集体液可以用普通针头(18-22G)直接穿刺,如果有条件建议使用蝴蝶针头/头皮针(butterfly needle),甚至在穿刺针头与注射器之间连一个三通管,但应注意正确运用三通管。这样胸腹腔采集时,不容易因为动物挣扎而脱落或刺伤内脏。
(4.1)胸水的采集
主要采用胸腔穿刺法收集实验动物的胸水。穿刺部位一般是胸腔后1/3,第6-8肋间肋软骨交界处。穿刺肋间肌时有一定阻力,当阻力消失有针落空感时,表明已刺入胸腔,即可缓缓抽取胸水。
Tips:
(1)动物应俯卧或站立保定,尤其是已有呼吸困难的动物,尽量不要侧卧保定或使用镇定、局麻,这会增加呼吸难度。
(2)操作中严防空气进入胸腔,始终保持胸腔负压。
(3)穿刺应用手控制针头的深度,以防穿刺过深刺伤肺脏。
(4)穿刺时应避免损伤肋间血管和神经。由于血管和神经贴着肋骨的后缘,为了不伤及它们,针头应该贴着肋骨的前缘进入。
如果实验不要求动物继续存活,也可处死实验动物剖开胸腔采集胸水。
(4.2)腹水的采集
主要利用腹腔穿刺法进行采集。穿刺点在腹下剑状软骨后方,腹中线两侧,小动物在腹中线肚脐后方1-2cm处,可以稍稍靠右侧以避开腹中线镰状脂肪与脾脏。
实验动物被固定于站立位,用注射器或穿刺套管针与腹壁垂直刺入,针尖有落空感后,腹水多时可见因腹压高而自动流出,如腹水太少,可借助注射器抽取。
Tips:
(1)采样前可让动物自行排尿或按摩排尿,排空膀胱以免误穿。
(2)如若腹水量较大,应缓慢地间歇地抽出,以免腹内压突然下降而导致动物出现循环功能障碍等问题。
(3)注意不可刺的太深,以免刺伤内脏。
消化液的采集
主要消化液有唾液、胃液、胆汁、胰液等。
(4.3)唾液的采集
在急性实验中,一般采用通过食物的颜色、气味等刺激动物的视觉、嗅觉而致动物唾液分泌增加,再引入导管收集唾液——用吸管直接插入动物口腔或唾液腺导管抽吸唾液。此法非常简单,但从口腔抽吸唾液会有杂质混入。
在慢性实验中,则采用制造腮腺瘘法采集唾液,这种方法可以收集到较纯净的唾液。(4.4)胃液的采集
急性实验时,同样通过刺激,使实验动物胃液分泌增加,采用插胃管的办法直接收集胃液。
先将动物麻醉,如果是犬等大型动物,可以将插胃管经口插入胃内,在灌胃管的出口连一注射器,以收集到胃液;如是大鼠,需手术剖腹,从幽门端向胃内插入一塑料管,再由口腔经食管将一塑料管插入前胃,用pH7.0、35℃左右的生理盐水,以12ml/h的流速灌胃,收集流出液。
在慢性实验中,收集胃液多用胃瘘法。应用该法,可以待动物恢复健康后,在动物清醒状态下反复采集胃液。
(4.5)胰液和胆汁的采集
需要进行手术。在动物实验中,主要是通过对胰总管和胆总管的插管而获得胰液或胆汁。有时也可通过制备胰瘘和胆囊瘘来获得胰液和胆汁。
尿液的采集
实验动物的尿液常用的采集方法较多,常用代谢笼采集,也可通过其他装置来采集。一般在实验前需给动物灌服一定量的水。
(4.6)代谢笼法
代谢笼是一种特别设计的为采集实验动物各种排泄物的密封式饲养笼,用于收集实验动物自然排出的尿液。此法较常用,适用于大鼠、小鼠。
将动物放在特制的代谢笼内,动物排便时,可以通过笼子底部的大小便分离漏斗将尿液与粪便分开,达到收集尿液的目的。
Tips:由于大鼠、小鼠尿量较少,操作中损失和蒸发,各个鼠膀胱排空不一致等原因,都可造成较大的误差,因此一般需收集5h以上的尿液,最后取平均值。
(4.7)导尿法
常用于犬、猴等大动物,动物轻度麻醉,仰卧固定于实验台上,由尿道插入导尿管,用甘油润滑导尿管。用导尿法导尿可采集到没有污染的尿液。如果严格执行无菌操作,可收集到无菌尿液。
(4.8)输尿管插管法
一般用于要求精确计量单位时间内实验动物排尿量的实验。
剖腹后,将膀胱牵拉至腹腔外,暴露膀胱底两侧的输尿管。在两侧输尿管近膀胱处用线分别结扎,于输尿管结扎处上方剪一小口,向肾脏方向分别插入充满生理盐水的插管,用线结扎固定插管,即可见尿液从插管滴出(前几滴是生理盐水),塑料管的另一端与带刻度的容器相连或接在记滴器上,以便记录尿量。
Tips:
(1)采尿过程中要用38℃热生理盐水纱布遮盖切口及膀胱。
(2)在实验过程中应经常活动一下输尿管插入管,以防阻塞。
(4.9)压迫膀胱法
实验人员用手在实验动物下腹部加压,当加的压力足以使动物膀胱括约肌松弛时,尿液会自动流出,即行收集。此法适用于兔、猫、犬等较大动物,可实现间隔一定的时间,收集1次尿液。
(4.10)膀胱穿刺法
实验动物麻醉固定后,剪去下腹部耻骨联合之上,腹正中线两侧的被毛,消毒后用注射针头接注射器穿刺。取钝角进针,针头穿过皮肤后稍微改变角度,以避免穿刺后漏尿,然后刺向膀胱方向,边缓慢进针边回抽,直到抽到尿液为止。
(4.11)反射排尿法
适用于小鼠,因小鼠被人抓住尾巴提起时排尿反射比较明显,可以利用这一反射收集尿液。
Tips:当鼠类被提起尾巴排尿后,尿滴挂在尿道外口附近的被毛上,不会马上流走,操作人员应迅速用吸管或玻璃管接住尿滴。
骨髓的采集
采集骨髓一般选择胸骨、肋骨、髁骨、胫骨和股骨等造血功能活跃的骨组织。
猴、犬、羊等大动物骨髓的采集用活体穿刺取骨髓的方法。先确定穿刺点,左手拇、食指绷紧穿刺点周围皮肤,右手持穿刺针在穿刺点垂直进针,小弧度左右旋转钻入,当有落空感时表示针尖已进入骨髓腔。用左手固定穿刺针,右手抽出针芯,连接注射器缓慢抽吸骨髓组织。
大、小鼠等小动物骨头小难穿刺,只能剖杀后采胸骨、股骨的骨髓。用颈椎脱臼法处死动物,剥离出胸骨或股骨,用注射器吸取少量的生理盐水,冲洗出胸骨或股骨中全部骨髓液。如果是取少量的骨髓作检查,可将胸骨或股骨剪断,将其断面的骨髓挤在有稀释液的玻片上,混匀后涂片凉干即可染色检查。
脑脊液的采集
(4.12)犬、兔脑脊液的采集通常采取脊髓穿刺法
穿刺部位在两髂连线中点稍下方第七腰椎间隙。
用左手姆、食指固定穿刺部位的皮肤,右手持腰穿刺针垂直刺入,当有落空感及动物的后肢跳动时,表明针已达椎管内(蛛网膜下腔),回抽,即可见脑脊液流出。
Tips:如果无脑脊液流出,可能是没有刺破蛛网膜,轻轻调节进针方向及角度;如果脑脊液流的太快,插入针芯稍加阻塞,以免导致颅内压突然下降而形成脑疝。
(4.13)大鼠脑脊液的采集可采用枕大孔直接穿刺法
在大鼠麻醉后,头部固定于定向仪上。头颈部剪毛、消毒,用手术刀沿纵轴切一纵行切口(约2cm)用剪刀钝性分离颈部背侧肌肉。为避免出血,最深层附着在骨上的肌肉用手术刀背刮开,暴露出枕骨大孔。由枕骨大孔进针直接抽取脑脊液。
Tips:采完脑脊液后,应注入等量的消毒生理盐水,以保持原来脑脊髓腔的压力。
广告:
出售实验专用的塑料管和塑料插管,外径在1mm左右,直径约1毫米左右,软硬合适,硬度适中,专门供应各个高校和科研院所以及研发单位。朋友从国外带来的,数量有限,售完为止,耐酸耐碱耐高温灭jun,数量有限售完为止
常用规格:
型号1(bt01):内径0.38mm(毫米),外径0.62 mm(毫米)
型号2(bt02):内径0.46mm(毫米),外径0.71 mm(毫米)
型号3(bt03):内径0.56mm(毫米),外径0.86 mm(毫米)
型号4(bt04):内径0.66mm(毫米),外径0.96 mm(毫米)
型号5(bt05):内径0.71mm(毫米),外径1.01 mm(毫米)
.....
以上仅列出部分型号,我们各种型号都有,品种多达十几种型号,全部现货供应!更多型号请联系客服电话:15305166390 ,QQ:515788166 。
具体外观请参考以下图片(全部实物拍摄),若有些图片变形,请点击图片查看原图:


继续阅读:
【 声明 】素材均取材于互联网,仅供参考
